Nat Commun│中国科学技术大学朱书/潘文等合作揭示维持上皮稳态的调控新机制
来源:生物探索 2024-04-18 08:50
炎症性肠病(IBD)是典型的复杂肠道疾病。免疫系统功能障碍、微生物组失衡和上皮屏障损伤是IBD的典型病理生理特征。
中国科学技术大学朱书、潘文、广州医科大学李明松及同济大学刘占举共同通讯在Nature Communications 发表题为“DHX9 maintains epithelial homeostasis by restraining R-loop-mediated genomic instability in intestinal stem cells”的研究论文,该研究观察到IBD患者和肠上皮条件性DHX9耗竭的小鼠DHX9蛋白水平降低(Dhx9ΔIEC)表现出对实验性结肠炎的易感性增加。
值得注意的是,Dhx9ΔIEC小鼠显示出ISCs和帕内特细胞的数量显著减少。进一步使用ISC特异性或潘氏细胞特异性DHX9缺陷小鼠进行的研究表明,ISC表达的DHX9参与维持上皮内稳态。机制上,DHX9缺陷导致R环异常聚集,导致基因组不稳定和 cGAS-STING 介导的炎症反应,共同损害ISC功能并促进 IBD的发病机制。总的来说,该研究强调了 ISC 中 R 环介导的基因组不稳定性是 IBD 的危险因素。

炎症性肠病(IBD)是典型的复杂肠道疾病。免疫系统功能障碍、微生物组失衡和上皮屏障损伤是IBD的典型病理生理特征。广泛的研究表明,免疫细胞在IBD的发病机制中起着关键作用。尽管免疫靶向疗法取得了重大进展,但由于疗效、副作用和耐药性不一致,其临床有效性有限。实现“黏膜愈合”已成为IBD长期缓解的标准。因此,更深入地了解IBD的病因,特别是控制上皮功能的调节机制,对于提高对其发病机制的认识至关重要。
肠上皮细胞(IEC)层维持着物理屏障,将宿主与食物抗原、共生微生物和其他细胞损伤分开。同时,IEC与肠道环境和宿主的免疫系统接触,使肠道稳态成为可能。为了应对周围环境的不断变化,IEC以3-5天的周转时间快速自我更新。这种快速更新由位于内陷隐窝底部的肠道干细胞(ISC)支持。ISC分化为祖细胞,祖细胞进一步增殖并分化为具有不同功能的特化IEC谱系。事实上,对IEC分化至关重要的几个关键基因已被证明在IBD期间表现出异常的表达模式。ISC分化的调节由来自隐窝内生态位的外部信号精确控制。多种细胞类型提供支持ISC功能并保证足够的ISC周转,从而使ISC能够分化为健康的上皮屏障。此外,某些细胞内信号或基因的异常也会影响ISC的活性和功能。因此,遗传和环境因素在ISC稳态的调节中都起着关键作用。
DEAH-box 解旋酶9(DHX9)是 DEAH-box RNA 解旋酶家族的重要成员。作为一种 ATP依赖性RNA解旋酶,DHX9可解旋RNA或DNA双链体,以及DNA:RNA杂交体(R-loops),使其成为DNA复制和转录的重要蛋白质。DHX9与多种细胞过程有,已成为肿瘤发生、感染和自身免疫性疾病的重要参与者。之前的研究已经阐明了DHX9和Nlrp9b在IEC中的合作关系,它们合作检测轮状病毒双链RNA(dsRNA),触发炎症小体复合物的形成。这种相互作用促进白细胞介素-18 和GSDMD诱导的焦亡的成熟。然而,DHX9在维持肠道稳态中的作用和机制在很大程度上仍未得到探索。
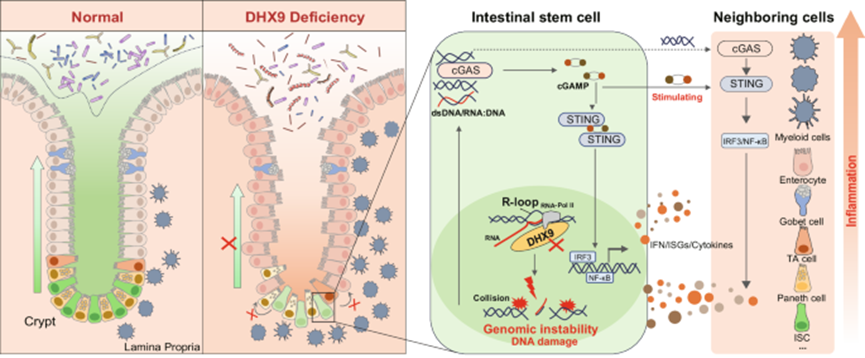
模式图(Credit: Nature Communications)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


